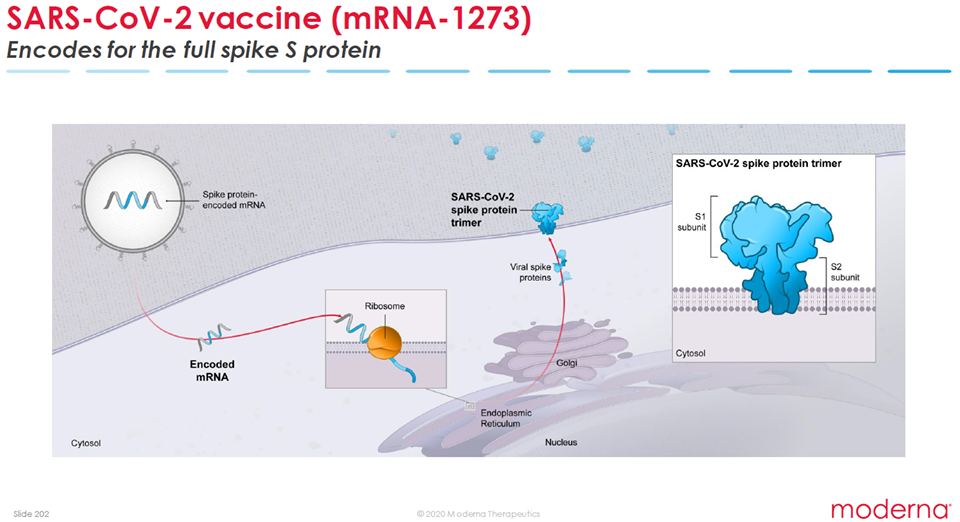
La fase 3 del vaccino (dal nome mRNA-1273), sviluppato da Moderna Therapeutics (azienda di biotecnologie americana) e il National Institute of Allergy and Infectious Diseases (Istituto nazionale per le allergie e le malattie infettive americano) ha inizio, come annunciato dall’NIH (https://www.nih.gov/news-events/news-releases/phase-3-clinical-trial-investigational-vaccine-covid-19-begins), e prevede il reclutamento di 30000 volontari (di età superiore ai 18 anni), i quali riceveranno una iniezione intramuscolare di 100 microgrammi (ug) a distanza di 28 giorni (https://clinicaltrials.gov/ct2/show/NCT04470427) in un trial randomizzato, controllato con placebo, con valutazione in cieco.
Da altre categorie

PALPITI D’AUTUNNO il nuovo libro di poesie del sangiovannese Giulio Giovanni Siena
redazione - 1 Febbraio 2026