di Federico Fabrizio
Negli ultimi giorni si è molto sentito parlare di un nuovo approccio incoraggiante nella cura del cancro basato su una tecnologia che consiste nel modificare il sistema immunitario per poi stimolarlo a reagire contro il bersaglio tumorale. Dal momento che risulterebbe complesso aggredire il tumore dell’esterno, l’ipotesi scientifica di potenziare il sistema immunitario allo scopo di eradicarlo sta trovando sempre più conferme. Tali osservazioni fanno riflettere come il sistema immunitario possa svolgere un ruolo molto più articolato di quello finora prospettato, contribuendo a “modellare” il tumore durante il suo sviluppo, determinando una sorta di “imprinting”.
Alla fine degli anni ottanta il Prof. Zelig Eshhar, chimico ed immunologo presso il “Weizmann Institute of Science” in Israele, ha ideato la tecnologia delle cosiddette cellule CAR-T (da cui deriva il nome CAR che è l’acronimo di Chimeric Antigen Receptors e la T definisce i linfociti T). Questa classe di globuli bianchi viene ingegnerizzata in modo tale che i recettori presenti sulla superficie esterna dei linfociti T possano riconoscere gli antigeni presenti sulle cellule tumorali, distruggendole. I vari punti della terapia cellulare sono illustrati nella figura sotto riportata e descritti come segue: 1) dal sangue del paziente sono prelevati i linfociti T mediante leucoaferesi; 2) tali linfociti vengono geneticamente modificati in laboratorio: mediante l’utilizzo di un virus non patogeno viene introdotto al loro interno un gene che permette di riconoscere le cellule tumorali; 3) i linfociti T riprogrammati vengono coltivati in laboratorio dove vanno incontro a moltiplicazione; 4) infine sono reinfusi nel paziente ed attaccano e distruggono le cellule tumorali. Naturalmente non mancano le incognite sugli effetti collaterali e sulle conseguenti implicazioni legate alla neurotossicità e Sindrome da Rilascio Citochinico (Cytokine Release Syndrome, CRS).
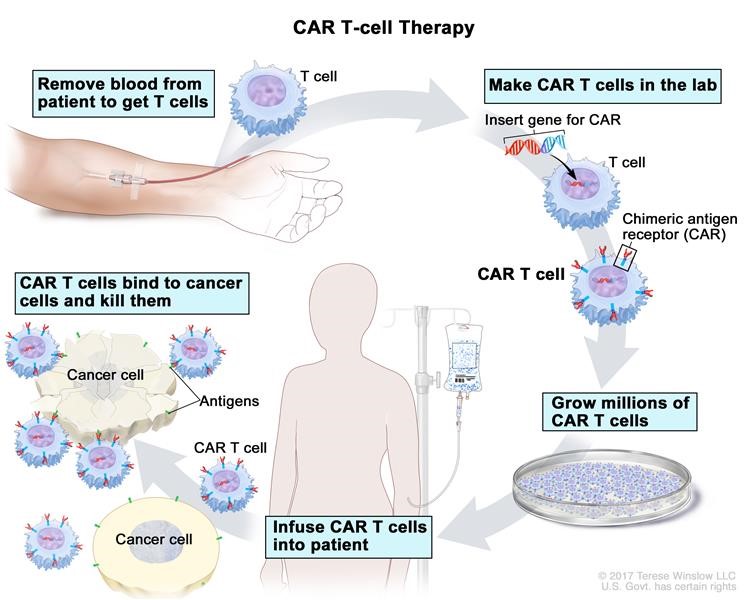
Le fasi della terapia CAR-T. Fonte: National Cancer Institute (https://www.cancer.gov/publications/dictionaries/cancer-terms/def/car-t-cell-therapy).
Sono passati circa una trentina di anni dalla fase di sviluppo alla prima sperimentazione della terapia genica con cellule modificate CAR-T negli Stati Uniti. Correva l’anno 2012 ed una bambina di nome Emily di 6 anni aveva lasciato un messaggio su Facebook con la speranza di poter guarire dalla leucemia linfoblastica acuta che le era appena stata diagnosticata. Grazie allo studio condotto dall’Università di Pennsylvania e documentato dalla dottoressa Lisa Rosenbaum in un editoriale pubblicato sul prestigiosissimo New England Journal of Medicine (NEJM) dal titolo “Tragedy, Perseverance, and Chance — The Story of CAR-T Therapy” (riportato al seguente link: http://www.nejm.org/doi/pdf/10.1056/NEJMp1711886), fortunatamente a 6 anni di distanza di quelle cellule leucemiche nel sangue di Emily non c’è più traccia.
Anche in Italia nello scorso anno è stato possibile utilizzare questa terapia cellulare con successo in un bambino di 4 anni, affetto da leucemia linfoblastica acuta di tipo B cellulare, refrattario alle terapie convenzionali presso l’Ospedale Pediatrico Bambino Gesù di Roma. Il gruppo di ricercatori guidati dal prof. Franco Locatelli, direttore del dipartimento di Onco-Ematologia Pediatrica, Terapia Cellulare e Genica ha eseguito un processo di ingegneria genetica che comporta la produzione di una sequenza genica (costrutto) realizzata appositamente per l’infusione. E’ un approccio più sicuro e controllato del precedente in quanto nel suddetto costrutto è stato necessario inserire un “interruttore di sicurezza” costituito dalla Caspasi 9 inducibile (iC9). Si tratta di un “gene suicida” che media il processo di apoptosi cellulare ed è in grado di inibire l’azione dei linfociti modificati. Il bambino sottoposto alla terapia oggi sta bene ed è stato dimesso.
A partire dall’agosto 2017, la Food and Drug Administration (FDA) ovvero l’agenzia americana che documenta e regolamenta l’immissione dei prodotti farmaceutici sul mercato, ha approvato il primo farmaco a base di CAR-T sviluppato dall’azienda Novartis, il tisagenlecleucel (il cui nome commerciale è Kymriah). L’infusione endovenosa di tale farmaco è destinata al trattamento di pazienti nella fascia di età fino ai 25 anni con leucemia linfoblastica acuta a cellule B, refrattaria o in recidiva post-trapianto. Il via libera è arrivato anche per l’axicabtagene ciloleucel (il cui nome commerciale è Yescarta) della Gilead approvato dalla Commissione dell’Unione Europea per combattere due forme aggressive di linfoma non Hodgkin: linfoma diffuso a grandi cellule B (DLBCL) e con linfoma primitivo del mediastino a grandi cellule B (PMBCL).
La medicina personalizzata in ambito oncoematologico sta aprendo le porte alla terapia genica con cellule ingegnerizzate sebbene la sfida sarà ottenere la massima disponibilità in termini di accesso alle cure per i pazienti investendo gli opportuni incentivi in innovazione e sostenibilità dei sistemi sanitari. Dopo che l’Agenzia europea per i medicinali (EMA) ha autorizzato la commercializzazione di entrambi i farmaci antigene chimerico CAR-T, in Italia la responsabilità ora passa nelle mani dell’Agenzia Italiana del Farmaco (AIFA) che dovrà stabilire un budget relativo ai costi per i vari centri specializzati designati ove potrà essere somministrata la terapia genica.
Da altre categorie